“In origine, quando la religione era forte e la scienza debole, gli uomini confondevano la magia con la medicina; ora che la scienza è forte e la religione debole, gli uomini confondono la medicina con la magia.”
— Thomas Stephen Szasz
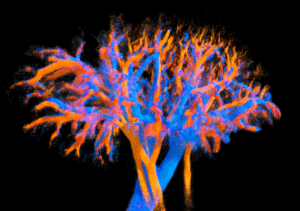
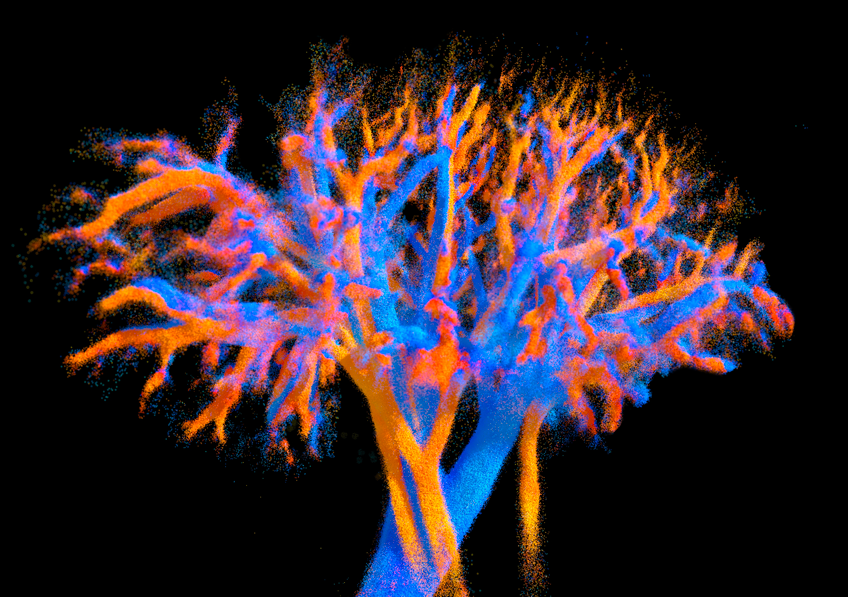
Per capire davvero come funziona un organo, non basta guardare i grandi vasi sanguigni: bisogna osservare i capillari, quella fitta rete microscopica che porta ossigeno e nutrienti fino alle cellule più lontane. È qui che si gioca buona parte della salute dei nostri organi. Problemi nella microcircolazione stanno dietro a malattie gravi come insufficienza cardiaca, patologie renali e disturbi epatici, ma ancora oggi abbiamo difficoltà a visualizzare queste strutture in modo dettagliato e non invasivo.
Un team di ricercatori francesi ha presentato una rivoluzionaria tecnologia ecografica che permette di osservare la microcircolazione di organi interi in tre dimensioni e con una precisione mai raggiunta prima. Non si tratta di fantascienza, ma di un passo importante verso diagnosi più precoci, medicina personalizzata e monitoraggio avanzato delle terapie vascolari. Questo metodo potrebbe cambiare radicalmente la diagnostica per immagini nel campo cardiovascolare, renale, epatico e neurologico.
Haidour, N., Favre, H., Mateo, P. et al. Multi-lens ultrasound arrays enable large scale three-dimensional micro-vascularization characterization over whole organs. Nat Commun 16, 9317 (2025). https://doi.org/10.1038/s41467-025-64911-z
Un limite storico: vedere il piccolo nel grande
Da anni medici e ricercatori cercano di ottenere immagini chiare dei piccoli vasi sanguigni all’interno di organi complessi. Tecniche come TAC e risonanza magnetica hanno fatto passi avanti, ma presentano limiti importanti: la prima non permette di osservare il flusso in tempo reale, la seconda ha costi elevati e una risoluzione insufficiente per i vasi più minuti. L’ecografia, invece, è economica e sicura, ma finora non era abbastanza precisa per cogliere i dettagli della microcircolazione.
L’introduzione della ultrasound localization microscopy (ULM) aveva già segnato una svolta, consentendo di localizzare microbolle iniettate nel sangue e “disegnare” i percorsi vascolari con una risoluzione ben oltre i limiti fisici dell’ecografia tradizionale. Tuttavia, le versioni precedenti della tecnica permettevano di analizzare solo piccole porzioni dell’organo, non volumi di grande scala come cuore intero o fegato.
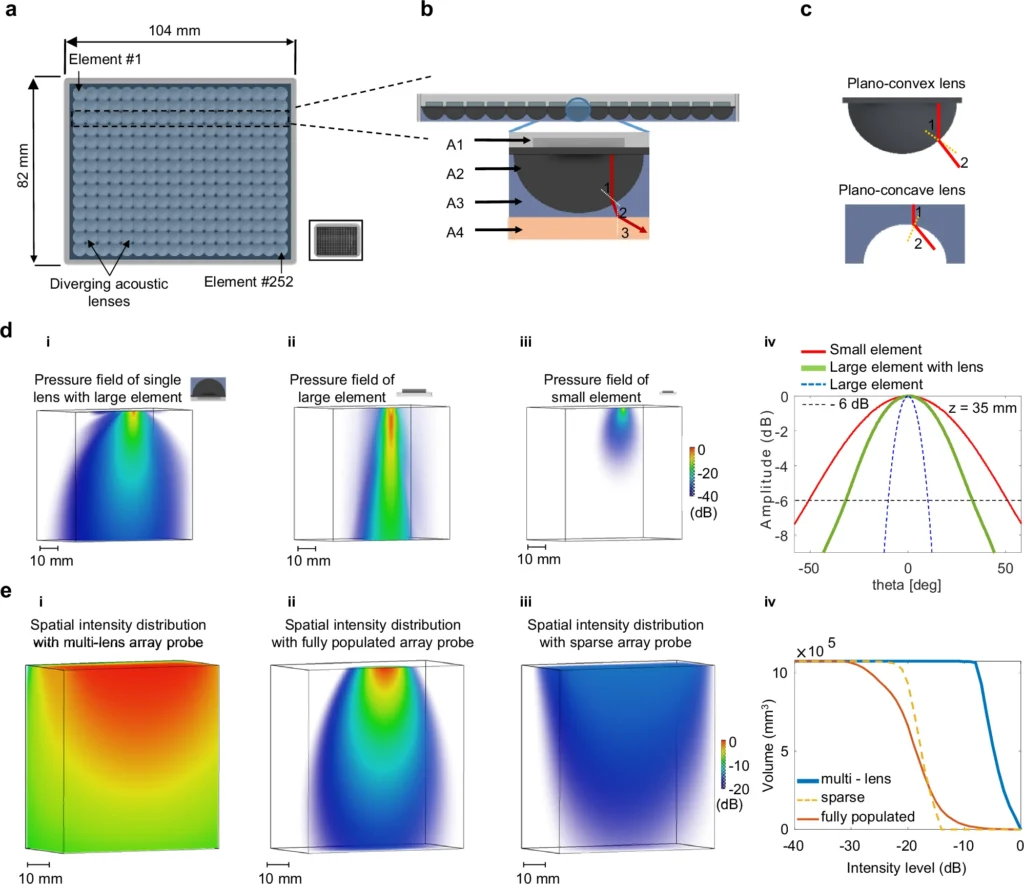
La svolta: un array multi-lente per vedere tutto l’organo
Il cuore dell’innovazione è una nuova sonda ecografica “multi-lente”. Invece di migliaia di piccoli elementi — costosi e complessi da gestire — utilizza poche centinaia di elementi più grandi accoppiati a piccole lenti acustiche che diffondono gli ultrasuoni in modo ottimale. Così si ottiene una copertura molto ampia del tessuto, con una sensibilità superiore e una risoluzione sorprendente: fino a circa 125 micrometri, più di dieci volte meglio degli ecografi clinici tradizionali.
Un altro vantaggio? Il sistema è veloce. Registra fino a 312 volumi tridimensionali al secondo, creando veri e propri filmati della circolazione sanguigna in azione, perfetti per studiare anche la dinamica del flusso e non solo la struttura dei vasi.
Questa combinazione — ampia copertura, super-risoluzione, e rapidità — è ciò che rende il metodo adatto allo studio di organi grandi e complessi come il cuore o il fegato.
Dal laboratorio all’animale: risultati su cuore, reni e fegato
I ricercatori hanno testato il sistema prima su modelli simulati, poi su tubicini con microbolle, e infine su animali (suini, scelti per la somiglianza anatomica con l’uomo). I risultati sono impressionanti.
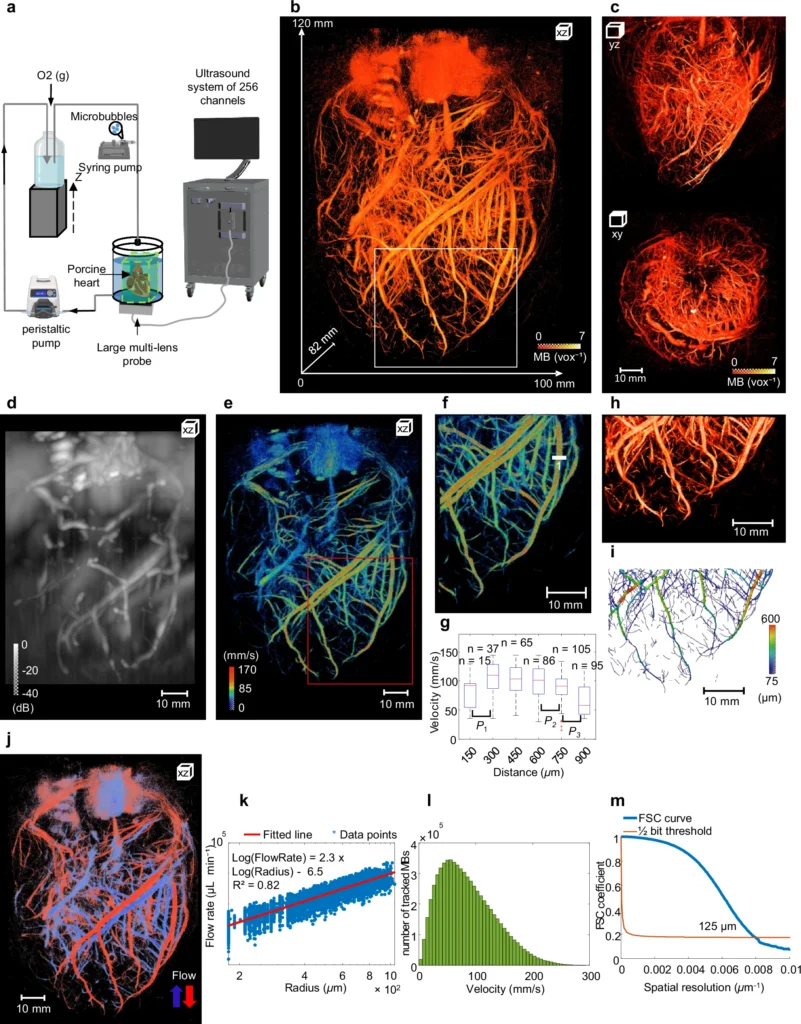
Sul cuore: mappatura completa delle coronarie
Su cuori perfusi al di fuori del corpo, la tecnologia ha ricostruito l’intero albero coronarico, misurando diametri dei vasi, direzione del flusso e velocità del sangue. Dettagli prima visibili solo con tecniche anatomiche invasive sono diventati accessibili in maniera non distruttiva. È stato persino possibile verificare leggi fisiologiche fondamentali come quella di Murray, che descrive la relazione ottimale tra diametro dei vasi e flusso sanguigno.
Sul rene: microvascolarizzazione in 3D e battito cardiaco
Nel rene, l’ecografia 3D ha permesso di distinguere arterie e vene e di osservare come cambia il flusso durante il ciclo cardiaco, identificando perfino piccole arteriole e venule. Questo apre la strada alla diagnosi precoce della malattia renale cronica, in cui i capillari periferici si alterano ben prima dei sintomi clinici.
Sul fegato: una sfida superata
Il fegato è un organo difficile da analizzare per la sua posizione e la forte interferenza respiratoria, ma anche qui il sistema ha ricostruito il flusso nelle grandi vene e nell’arteria epatica, mostrando variazioni pulsatile e distinguendo i diversi sistemi vascolari (arterioso, venoso e portale).
Perché questa tecnologia cambia il gioco
Questa innovazione porta tre vantaggi chiave:
1. Diagnosi più precoci
Guardare la microcircolazione significa cogliere i primi segnali di malattia, quando è ancora possibile intervenire con terapie efficaci. Pensiamo a:
- insufficienza cardiaca iniziale
- nefropatia diabetica
- cirrosi epatica precoce
- malattie neurodegenerative legate alla microvascolarizzazione
2. Medicina personalizzata e IA
Le immagini tridimensionali e dinamiche generano un’enorme quantità di dati. Questi contenuti possono alimentare sistemi di intelligenza artificiale, e dare vita a “digital twin” degli organi: modelli virtuali su misura con cui simulare interventi, terapie e progressione della malattia.
3. Accessibilità clinica
Il sistema usa tecnologia ecografica, molto più economica e diffusa rispetto a TAC o risonanza magnetica. Questo significa che, una volta maturato, potrà essere usato negli ospedali, nei centri periferici e persino, in futuro, in medicina d’urgenza.
In conclusione…
La ricerca descritta non è solo un avanzamento tecnologico: rappresenta un possibile cambio di paradigma. Per la prima volta, possiamo immaginare di osservare in tempo reale e su organi interi ciò che finora era riservato a microscopia, anatomia patologica o modelli parziali: il microcosmo vascolare che sostiene la vita degli organi.
La strada verso l’applicazione clinica richiede ancora test, miniaturizzazione della sonda, protocolli per l’uso umano e ottimizzazione dell’elaborazione dati. Ma il percorso è tracciato. In un futuro non lontano, diagnosi precoci, monitoraggio delle terapie e interventi personalizzati potrebbero passare da un semplice ecografo — potenziato, reinventato, reso capace di vedere l’invisibile.
Il cuore, il rene, il fegato e forse presto il cervello potranno essere osservati come non mai: non più solo organi, ma mondi pulsanti di vita microscopica finalmente visibile.